张隽佶和贺晓鹏团队利用光控荧光染料实现超高分辨精准成像
酶是人体不可或缺的生物大分子,可通过催化底物的化学反应调控细胞的正常功能。然而,酶的催化活性异常与人类重大疾病的发生与发展密切相关(如癌症、细胞衰老等)。近期,教育部前沿科学中心与中科院上海药物所、国家蛋白质中心、美国得克萨斯大学奥斯丁分校以及英国巴斯大学合作,在酶激活型光控荧光染料的超高分辨成像方面的研究工作取得重要进展,研究成果以“Photochromic Fluorescent Probe Strategy for the Super-resolution Imaging of Biologically Important Biomarkers”为题全文发表于《美国化学会志》(Journal of the American Chemical Society)。
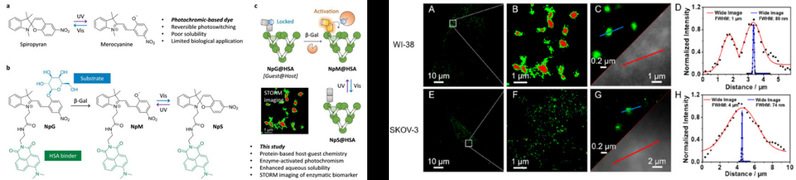
前期研究中,该团队通过构建螺吡喃-萘酰亚胺光控荧光染料体系,实现了肝癌细胞的靶向光控荧光成像(Nat. Commun. 2017, 8, 987),进而通过人血清白蛋白(HSA)的引入,构建了光控探针/蛋白质复合物,提升了探针的双荧光发射性能,实现了肝癌细胞的靶向双荧光循环成像(J. Am. Chem. Soc. 2018, 140, 8671)。在此基础上,团队在光致变色基团螺吡喃结构中引入了可被β-半乳糖苷酶(β-Gal)水解的β-半乳糖基团,同步抑制了螺吡喃的光致变色性能和荧光性能,并进一步将探针与HSA结合,形成光学性能增强的蛋白复合体。复合探针被细胞内化后受β-Gal催化水解β-半乳糖残基,从而同步激活螺吡喃分子的光致变色和荧光性能。基于探针独特的光控“荧光闪烁”性能,他们运用超高分辨成像技术(STORM—随机光学重建显微镜)提升了探针的衍射极限(分辨率74-80 nm),在亚细胞层次实现了β-Gal在卵巢癌细胞和衰老细胞中的活性分布探测。实验表明,卵巢癌细胞的β-Gal倾向于均匀分布在胞质中,而在衰老细胞中倾向于溶酶体分布。平行应用膜检测算法(membrane detection algorithm)分析了两种不同细胞中酶分布的数据信息,构建了两种不同病理状态下的多边形模型图,为酶催化生物大分子动态修饰的亚细胞水平精准成像提供了新的化学工具。